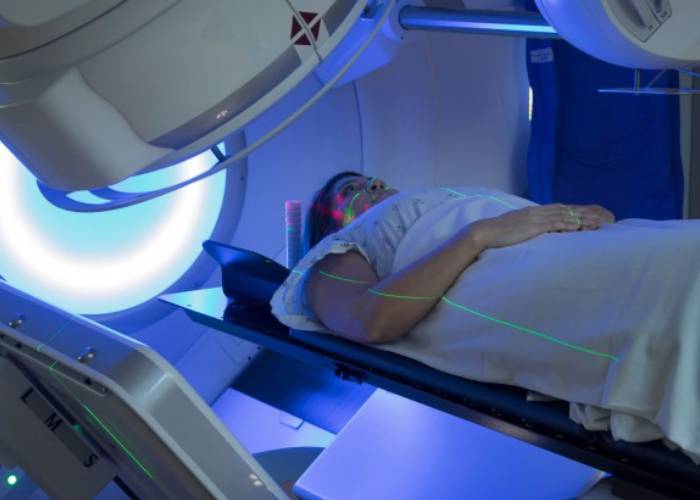
پرتودرمانی برای مبارزه با سرطان در بسیاری از موارد بهعلت خطر بروز سندرم گوارشی ناتمام میماند ولی بهتازگی پژوهشگران روشی برای حل این مشکل پیدا کردهاند.
پرتودرمانی (رادیوتراپی) روش رایج درمان سرطان و یکی از موثرترین راهها برای تخریب سلولهای سرطانی و کاهش اندازهی تومورها است. حدود ۵۰ درصد از بیمارانی که دارای تومور در حفرهی گوارشی خود هستند (کبد، پانکراس، روده، پروستات و ..) تحت این روش درمانی قرار میگیرند که طی دهههای گذشته موجب افزایش نرخ ماندگاری افراد مبتلا به سرطان شده است. البته پرتودرمانی شدید نهتنها به سلولهای تومور آسیب وارد میکند بلکه در ۶۰ درصد از موارد، سلولهای سالم روده را نیز در مسیر سمی شدن قرار میدهد.
درحالیکه معمولا این روند پس از توقف پرتودرمانی معکوس میشود، ۱۰ درصد از افراد درمان شده دچار سندرم گوارشی میشوند؛ یک بیماری که مشخصهی آن مرگ سلولهای رودهای است و منجر به تخریب کل روده و مرگ بیمار میشود. آسیب وارده به سلولهای رودهای سالم مهمترین عیب پرتودرمانی است که منجر به توقف و شکست درمان مؤثر سرطان میشود و میتواند موجب عود سریع تومور شود.
کشفی که بهتازگی بهوسیلهی گروه فاکتورهای رشد، مواد مغذی و سرطان مرکز ملی پژوهشهای سرطان اسپانیا (CNIO) در مجلهی Science منتشر شده است، شاید در حفاظت از سلولهای رودهای سالم از آسیب ناشی از اشعه مفید باشد. دستاوردهای این مطالعه ممکن است موجب ایجاد تغییراتی اساسی در نحوهی مدیریت مواجهه با سطوح بالای اشعه هم در حوزهی پژوهش و درمان سرطان و هم در حوزههایی نظیر اکتشافات فضایی، جنگ هستهای یا حوادث هستهای شود.
تمرکز این کارگروه روی URI است؛ پروتئینی که عملکردهای آن هنوز بهطور کامل شناسایی نشده است. اگرچه نتایج یک مطالعه پیشین نشان داده است که سطوح غیرطبیعی بیان این پروتئین در برخی اعضای بدن میتواند موجب سرطان شود. این مطالعه که در مجلهی Science منتشر شده است، نشان میدهد که سطوح بالای پروتئین URI از موش دربرابر آسیبهای رودهای ناشی از اشعه محافظت میکند، درحالیکه سطوح پایین یا غیرقابل تشخیص این پروتئین میتواند منجر به سندرم گوارشی و مرگ شود. نابیل جودر رئیس گروه فاکتورهای رشد، مواد مغذی و سرطان در CNIO و نویسندهی مطالعه میگوید:
عملکردهای دقیق URI هنوز شناسایی نشده است. درست مانند pH یا دما که لازم است در محدودهی خاصی برای بقای ارگانیسم حفظ شود، سطوح URI نیز برای تنظیم عملکرد مناسب دیگر پروتئینها باید در یک پنجرهی بسیار باریک حفظ شود. هنگامی که سطوح URI بالاتر یا پایینتر از سطح بهینه باشد، این پروتئین ممکن است بستهبه شرایط از رشد تومور و دیگر بیماریها جلوگیری کرده یا اینکه موجب تشویق رشد این بیماریها شود.
جودر که مدتها است درحال مطالعهی URI است، نخستین مدلهای ژنتیکی موش را برای مطالعهی عملکردهای این پروتئین در پستانداران توسعه داده است. تیم او مشاهده کرده است که در محیط کشت سلولی، سطوح بالای URI از سلولهای رودهای دربرابر آسیب DNA محافظت میکند. بنابراین دکتر جودر و دیگر همکارانش خواستند این مطلب را مورد بررسی قرار دهند که آیا همین عملکرد حفاظتی URI در بدن موجود زنده نیز وجود دارد و اینکه آیا این پروتئین قادر به کاهش اثرات حاصل از تابش شدید اشعه و سندرم گوارشی است یا خیر.
برای پرداختن به این موضوع، سه مدل ژنتیکی موش توسعه داده شد. این مدلها نخستین مدلهای ژنتیکی آزمایشی موش بودند که بهصورت خاص برای مطالعهی نقش URI و اثرات تابش روی روده توسعه داده شدند. یکی از آنها بهعنوان یک مدل کنترل برای شناسایی محل دقیق بیان URI در روده مورد استفاده قرار گرفت؛ مدل موش دیگر دارای سطوح بالاتری از پروتئین بیان شده در روده بود و در سومی ژن کدکنندهی این پروتئین حذف شده بود بهصورتی که سطح تولید URI در اپیتلیوم رودهی او کاهش پیدا کند. موشهای گروه کنترل نشان دادند که URI در جمعیتی از سلولهای بنیادی خاصی که در غدد رودهای (غدد لیبرکان یا غارهای لیبرکان) قرار دارند، بیان میشوند. URI از این سلولها دربرابر سمیت حاصل از تابش اشعه محافطت میکند. چاوز پرز نویسندهی نخست مقاله میگوید:
ما دریافتیم که وقتی تیمار اشعه تمام میشود، این سلولها سلولهایی هستند که موجب احیای بافتهای آسیب دیده میشوند. اخیرا بحثهای زیادی درمورد اینکه کدام جمعیت سلولهای بنیادی مسئول انجام این کار هستند، وجود داشته است.
پس از مواجهه با تابش شدید، ۱۰۰ درصد از موشهای مهندسی شده برای بیان سطوح بالای URI در روده، از سندرم گوارشی جان سالم به در بردند درحالیکه در شرایط طبیعی، تا ۷۰ درصد آنها میمردند. ازطرف دیگر تمام موشهایی که ژن کدکنندهی این پروتئین در آنها حذف شده بود، در اثر سندرم گوارشی مردند. چاوز پرز این نتایج را توضیح میدهد:
چیزی که باعت تمایز این جمعیت سلولهای بنیادی خاص میشود این است که تحت شرایط طبیعی (وقتی که URI را بیان میکنند)، این سلولها خاموش هستند یعنی تکثیر نمیشوند. بنابراین آنها در معرض آسیب ناشی از اشعه که تنها سلولهای در حال تکثیر را متاثر میکند، قرار نمیگیرند. اما وقتی URI در این سلولهای بنیادی وجود ندارد، آنکوژن c-MYC بیش از اندازه بیان میشود و منجر به تکثیر سلولی و افزایش حساسیت این سلولها نسبتبه آسیب ناشی از اشعه میشود. بهعنوان یک پیامد، این سلولها میمیرند، روده خود را ترمیم نمیکند و درنهایت جانور از دنیا میرود.
اگرچه لازم است که نتایج آنها در مطالعات دیگری تأیید شود، جودر معتقد است که بازدارندههای c-MYC ممکن است برای کاهش سندرم گوارشی ناشی از اشعه در بیماران سودمند باشد. جودر توضیح میدهد:
پژوهش ما مسیرهای جدیدی را برای درمان و پیشگیری از سندرم گوارشی ازطریق مهار یا حذف c-MYC باز میکند. چنین مهارکنندههایی موجب کاهش اثرات جانبی مرگبار اشعه درمانی میشود و امکان افزایش شدت تابش اشعه را برای درمان کارآمدتر سرطان و حفاظت از بیماران از سندرم گوارشی مهیا میکند. علاوهبر حفاظت دربرابر اثرات جانبی مرگبار حاصل از اشعه، مهارکنندههای c-MYC در درمان سرطان نیز مورد استفاده قرار میگیرند.
اکنون موضوع جالب این است که بدانیم که آیا دیگر اعضای بدن که دارای قدرت بازسازی هستند، مانند پوست نیز دارای جمعیت سلولهای بنیادی خاصی با سطوح بالای URI هستند. جودر و گروهش در حال حاضر در حال انجام پژوهشهایی در این زمینه هستند. جودر اعتقاد دارد که جدای اهمیت این نتایج در حوزهی سرطان، این یافتهها ممکن است دارای تلویحات مهمی برای حفاظت دربرابر تابش شدید اشعه مانند حوادث هستهای، جنگ هستهای یا مواجهه با اشعههای کیهانی در جریان اکتشافات فضایی باشد.
.: Weblog Themes By Pichak :.
